上海泉众机电科技有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
推荐产品
公司新闻/正文
动脉粥样硬化中的内皮细胞力学生物学
5394 人阅读发布时间:2025-10-24 15:43
Endothelial mechanobiology in atherosclerosis
Keywords: Antiatherogenic drugs; Cardiovascular disease; Endothelial cells; Mechanotransduction; Shear stress.
心血管疾病(CVD)是一项严重的健康挑战,在世界范围内造成的死亡人数超过癌症。血管内皮,由内皮细胞(ECs)组成,位于血管的最内层,在维持血管完整性和体内平衡方面起着核心作用,并与血流直接接触。ECs 对流体剪切应力(FSS)非常敏感,FSS 是体内平衡的关键决定因素,但也可能是疾病的诱因(图1)。SS 的大小使用可互换的单位(1 Pa = 1 N/m2 = 10 dynes/cm2)表示,该值受血流速度、血管内半径和血液粘度变化的影响。
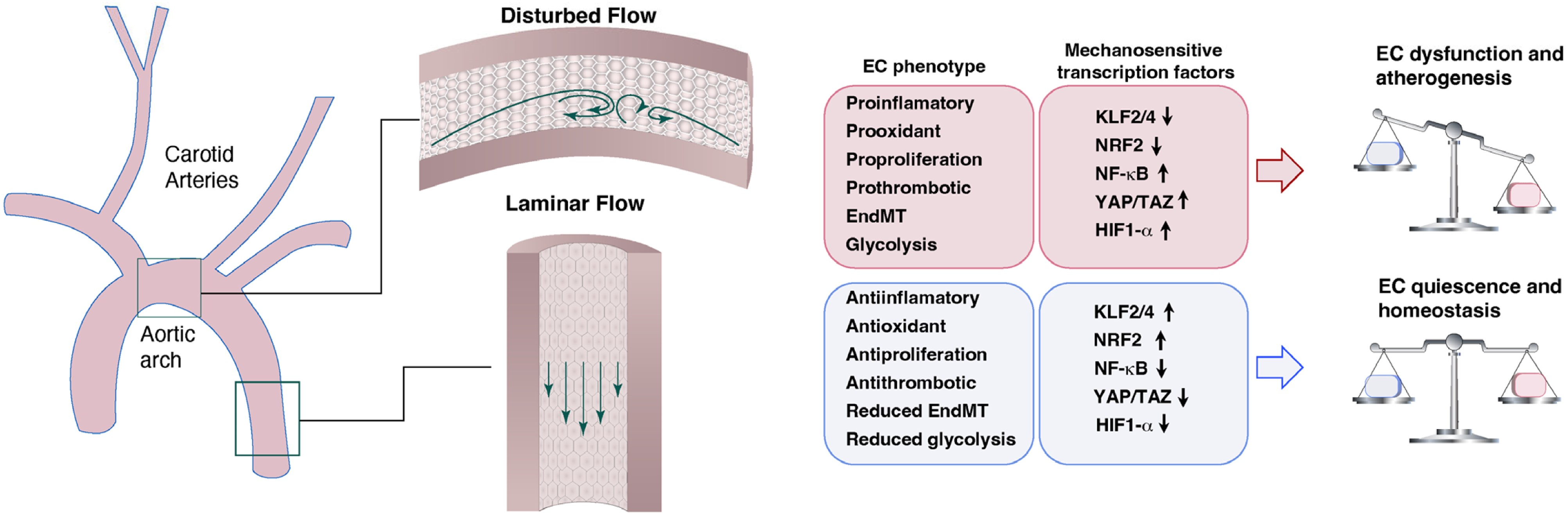
图1 血流动力学SS 及其在血管病理生理学中的作用。经受层流的 ECs 表现出抗炎、抗氧化和抗增殖表型,伴有 EndMT 和糖酵解减少,从而维持 EC 静息和血管稳态。相应的血流响应机制包括 KLF2、KLF4、NRF2 和其他保护通路。相比之下,血流紊乱区域中的 ECs 表现出促炎、促氧化、促增殖反应和增强的 EndMT 内皮表型。因此,血流紊乱导致 ECs 功能障碍和动脉粥样硬化形成。血流紊乱介导的内皮功能障碍的机制包括 NF-κB、YAP/TAZ 和 HIF-1 等通路的激活。
细胞面临着不同的物理、生化和生物力学环境,并具有对这些信号做出反应以维持适当生物功能的能力。研究表明,血管壁的机械扰动有助于动脉粥样硬化的形成和发展。当动脉的直段部分暴露于持续的层流和生理性高剪切应力下时,分支点附近或弯曲血管中的血流可能会表现出“扰动性”的流动。临床研究以及体外分析已经证实,这些扰流区域,包括低剪切应力、再循环、振荡或横向流动,是动脉粥样硬化病变形成的优先部位。由于血管 ECs 在血流稳态中起关键作用,因此具有机械感应机制,使它们能够对机械力的变化做出快速反应,并执行特定环境的适应性反应来调节 EC 功能。基于此,四川大学华西基础医学与法医学院生物医学工程研究室、浙江大学医学院附属邵逸夫医院心内科及美国马萨诸塞州总医院和哈佛医学院放射肿瘤科联合团队在一项综述中总结了目前对内皮细胞力学生物学的理解,以期指导确定新的治疗靶点以减缓或逆转动脉粥样硬化的进展。研究成果发表于 Cardiovascular Research 期刊题为“Endothelial mechanobiology in atherosclerosis”。

研究 FSS 对 ECs 影响的方法
为了研究 EC 对 SS 的反应机制,已经开发了各种模型来模拟体内血流环境。体外模型(图2)可以为研究内皮生物学提供良好的控制条件。然而,这些模型的局限性在于它们不能完全概括复杂得多的血管解剖结构或机械特性。另一方面,体内模型(图3)与疾病过程更相关,但动物模型中的流体动力学难以准确测量或控制。因此,体内和体外方法的结合更有助于我们目前对内皮力学生物学和动脉粥样硬化的理解。选择合适的模型来研究 FSS 对 ECs 的影响取决于要研究的特定内皮过程。通过表征体外模型生成的 FSS 图谱并将它们与动脉粥样硬化中鉴定的 FSS 图谱配对,可以更详细地描述机械力对内皮健康和病理生理学的贡献。
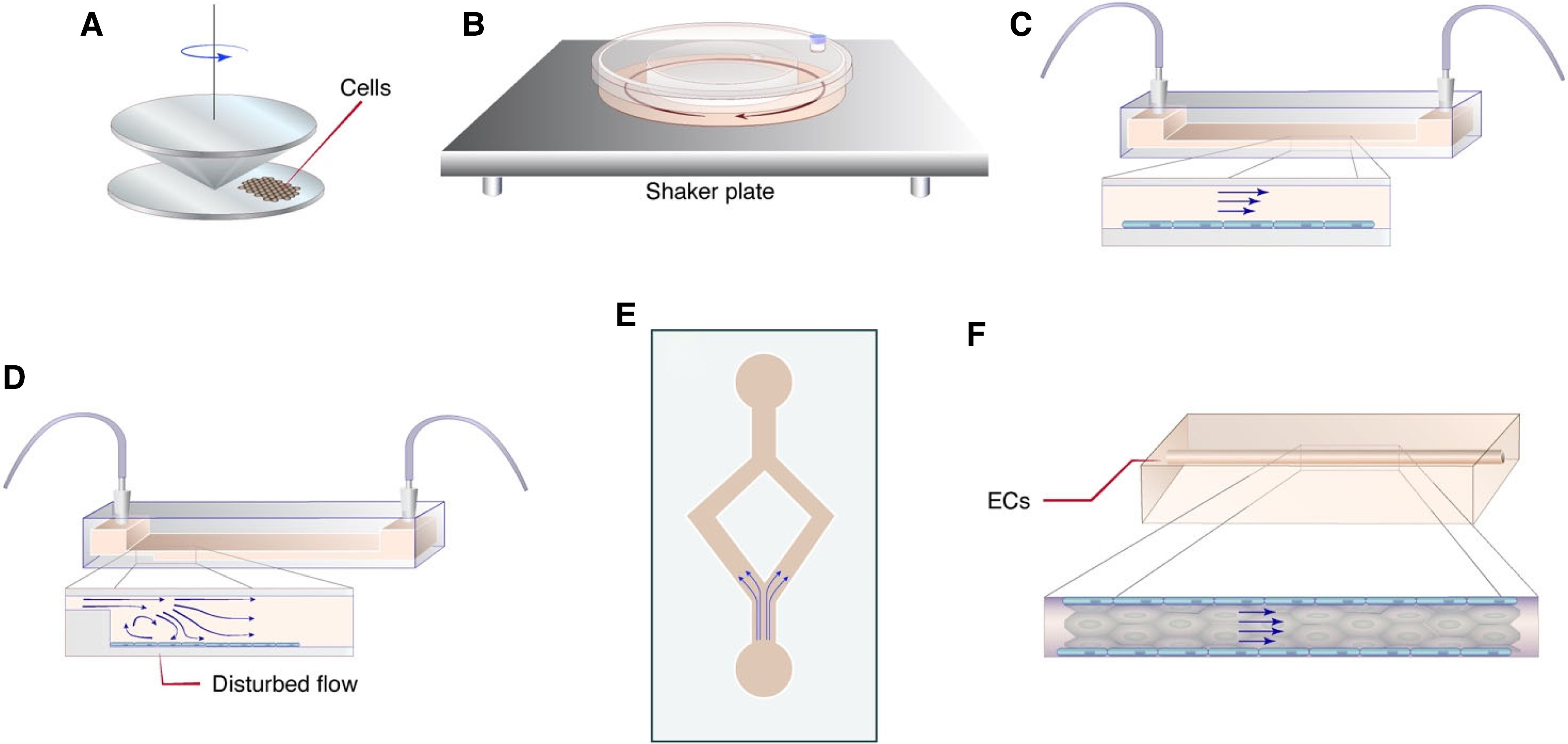
图2 体外研究内皮 SS 的方法。(A)改进的锥板粘度计系统,用于应用空间均匀的 SS。(B)由培养皿构建的剪切环装置,通过放置在摇床板上来驱动流动。(C)平行板流通室,流量由注射泵控制。(D)阶梯流室。由平行板流动室修改而建。(E)微流体装置中的分叉通道。(F) 在水凝胶(例如胶原蛋白 I)中浇铸的圆柱形通道,涂有 ECs。
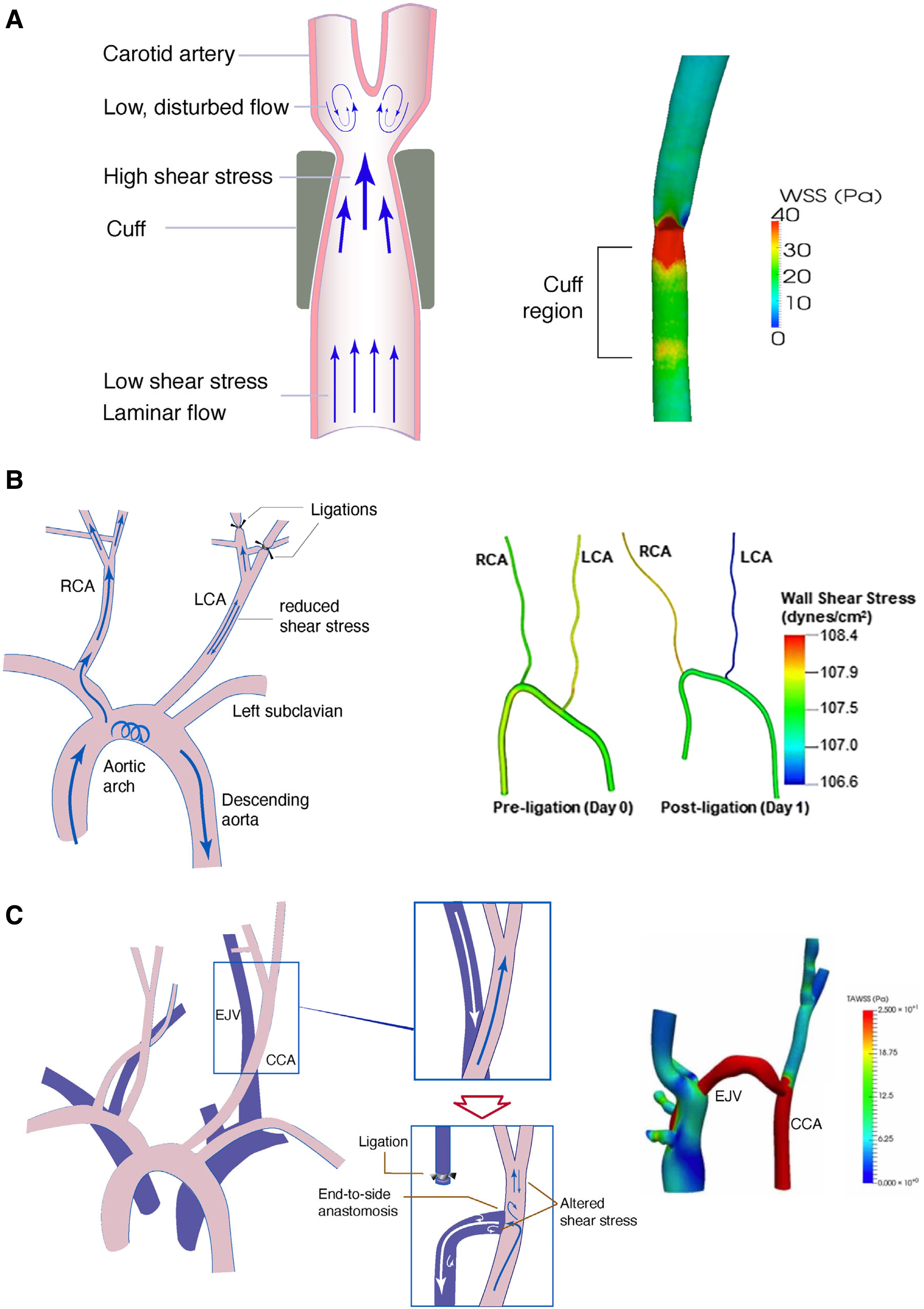
图3 调控内皮 SS 的体内方法。(A)在 SS-袖带模型中,在右颈动脉(RCA)周围放置限制性袖带以改变血流。由此产生的SS 变化可用 CFD 进行估计。上游层流 SS 和下游振荡 SS 降低。(B)部分结扎模型。左颈动脉(LCA)的三个分支被结扎,从而减少 LCA 中的 SS。(C)动静脉瘘(AVF)模型。颈总动脉(CCA)和颈外静脉(EJV)之间建立连接,导致吻合口附近多个区域的血流受阻。
ECs 对 FSS 的响应
1. EC 形态
体外和体内研究已清楚地确定,高层流 SS 区域中的 ECs 沿流动方向伸长并与其平行,在中心区域排列整齐,形成平行排列的肌动蛋白应力纤维。而静态培养或暴露于扰动流的细胞是随机定向的,呈现更多边形的形状,它们的肌动蛋白丝很短,主要位于细胞外围。与血流方向平行的 EC 排列很可能是一种适应反应,可以减少血流阻力并诱导内皮细胞中的促存活信号。扰乱的血流或低 SS 导致 ECs 排列不一致,从而使它们暴露于更高的 SS 梯度,并可能使这些区域发生动脉粥样硬化。
2. EC 周转率
层流导致 EC 周转率降低,并使 ECs 处于相对非增殖的状态,这与 DNA 合成抑制和细胞周期进程抑制有关,大多数细胞停滞在 G0 或 G1 期。相反,振荡/低 SS 促进 EC 周转,其特征是抑制 p21 通过 G0/G1-S 转换增加 DNA 合成和增殖。
3. EC 渗透性
在生理性高层流 SS 的情况下,相邻的 ECs 紧密相连并限制脂蛋白等大分子的通过。相反,扰动流会导致屏障破坏并增加对大分子的渗透性。扰动血流导致低密度脂蛋白(LDL)的大量内膜清除率,使大量 LDL 渗入内膜。低/振荡 SS 通过减少内皮细胞上的窗孔数量来增加内弹性膜和弹性薄片的通透性,从而增加大分子在动脉壁中的积累。此外,已经报道了血管壁中白蛋白和 LDL 等大分子摄取的剪切依赖性。与细胞在静态条件下的摄取相比,较低的 SS 导致 EC 对LDL 的摄取增加,而在较高的 SS 下摄取减少。
4. 内皮-间质转化(EndMT)
虽然层流 SS 对 EndMT 具有保护作用,但 ECs 暴露于紊乱血流会经历 EndMT,从而导致动脉粥样硬化。对人冠状动脉的分析表明,成纤维细胞生长因子受体1(FGFR1)表达降低、TGF-β信号激活、EndMT的发生与动脉粥样硬化的严重程度有很强的相关性。使用平行板系统和部分颈动脉结扎模型,研究证实 ALK5(TGFβR1)是负责Mechano-EndMT(机械力诱导的内皮-间质转化)的受体,而Src同源蛋白和胶原蛋白(Shc)在扰动 SS 区域充当 EndMT 和动脉粥样硬化的关键下游驱动因素。此外,3D微工程人冠状动脉芯片中的振荡 SS 诱导 ECs 转变为促炎性 EndMT 表型,并促进动脉粥样硬化形成,这是由 Notch1/p38 MAPK-NF-κB 信号通路介导的。
5. 抗凝活性
生理层流 SS 促进抗凝血特性,与 ECs 的动脉粥样硬化保护表型一致。前列环素是第一个在剪切力作用下从 ECs 中释放的血小板聚集抑制剂。层流 SS 诱导的血管扩张剂一氧化氮(NO)的释放也是 ECs 抑制血小板聚集特性的原因。在高 SS 的层流下,KLF2 介导的血栓调节蛋白(TM)上调是大动脉中抗血栓形成和抗动脉粥样硬化的重要保护性机制。
6. 白细胞粘附和迁移
大量研究表明,层流与循环白细胞对 ECs 的粘附减少有关,该过程涉及抑制 ECs 中粘附分子和趋化蛋白(例如 VCAM-1 和 MCP-1)的表达。相反,SS 改变的扰动流会促进白细胞结合和迁移,导致白细胞在动脉中积累,增加动脉粥样硬化形成的倾向。此外,越来越多的证据表明,剪切力参与整合素介导的白细胞停滞。血流动力学扰动可以激活中性粒细胞并诱导中性粒细胞胞外诱捕网(NETs)的释放。
7. 脂质代谢
层流抑制 ECs 中的脂质积累,因为生长停滞基因的上调而降低 LDL 通透性,并且由于甾醇调节元件结合蛋白1(SREBP1)的下调而降低脂质摄取和合成。相反,扰动流诱导 SREBP1 的持续激活,从而导致 SRE 介导的 EC 基因转录激活增加,从而促进脂质摄取和脂质合成。
8. SS 和 EC 与邻近细胞的相互作用
由于 ECs 不单独存在于血管壁中,因此 ECs 与血管壁中的其他细胞之间存在串扰,这些细胞类型之间的相互作用对于正常的血管功能很重要。先前的研究表明,ECs 可以将 SS 诱导的信号传输到 VSMCs,且 VSMCs 也表现出对 EC 的反馈控制。机械刺激下的净动脉重塑受来自 ECs 的生长抑制信号和来自 VSMCs 的生长刺激信号之间的动态相互作用控制。这些结果强调了在研究内皮力学生物学和血管病理学中考虑细胞间通讯的重要性。
总之,ECs 通过结构和功能适应来响应层流和扰动流,这涉及 EC 形态变化和基因表达的重编程,以调节细胞功能(如增殖、通透性、EndMT、白细胞外渗、凝血和脂质积累)(图4)。这些反应有助于血管稳定和体内平衡重塑,是发育过程中血管结构的关键决定因素。
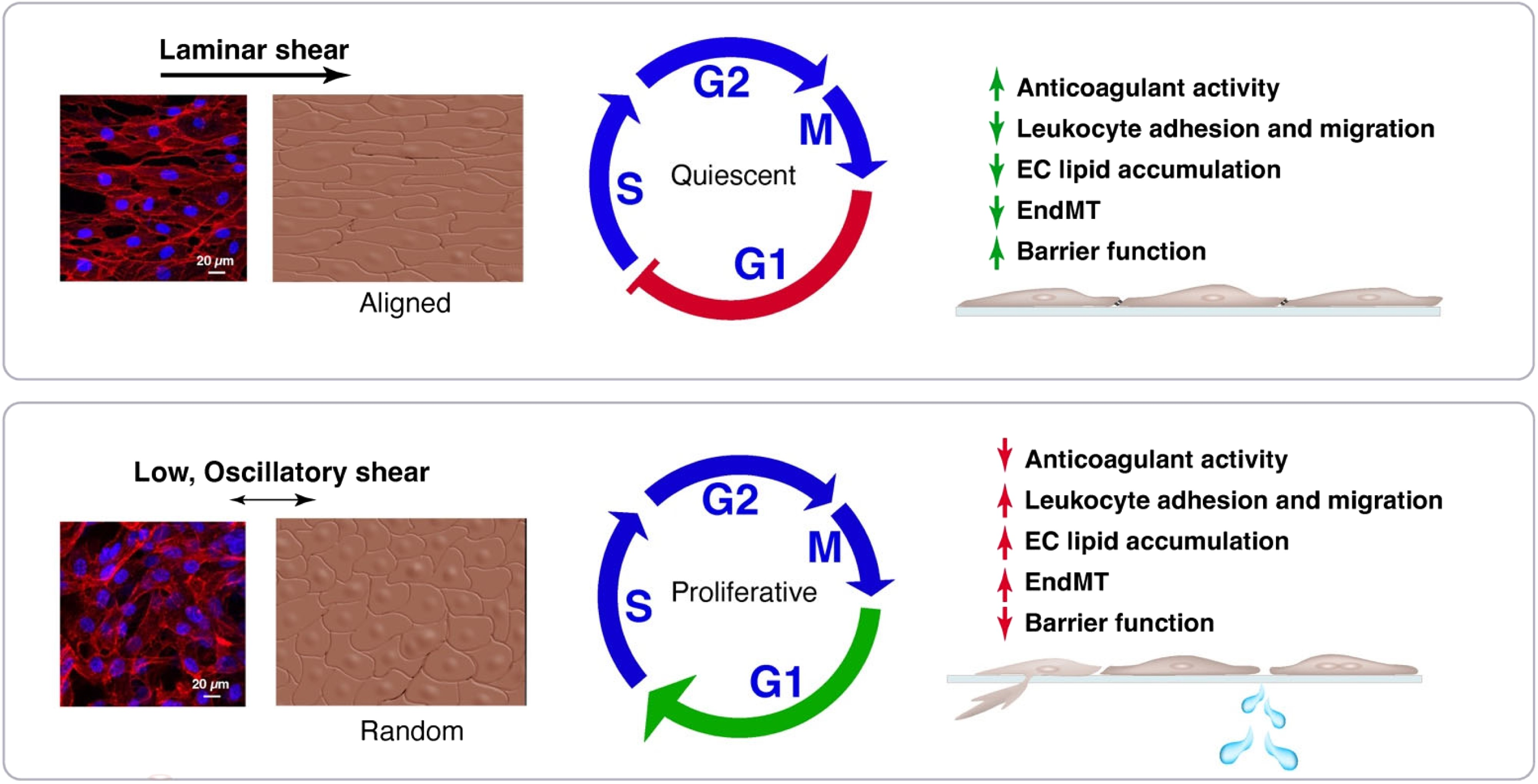
图4 内皮细胞对SS的反应。
内皮机械传感器和机械传导机制
许多膜相关分子和微结构域已被确定为 ECs 中的机械传感器,并介导机械刺激向细胞内信号的转换,包括离子通道、局灶性粘附(FAs)、受体-酪氨酸激酶(如血管内皮生长因子受体VEGFR)、G 蛋白偶联受体(GPCR)、糖萼、原代纤毛和小窝(图5)。通常,EC 膜上的机械传感器直接感应血流并将机械信号转导到细胞中。这些机械传感器的表达/结构改变导致机械转导的改变,以及内皮功能障碍的发生,表现为内皮损伤、白细胞与活化内皮的粘附、EndMT、氧化应激/炎症反应增加、衰老和高渗透性。因此,内皮细胞功能障碍易导致动脉粥样硬化斑块和其他血管疾病的发展。
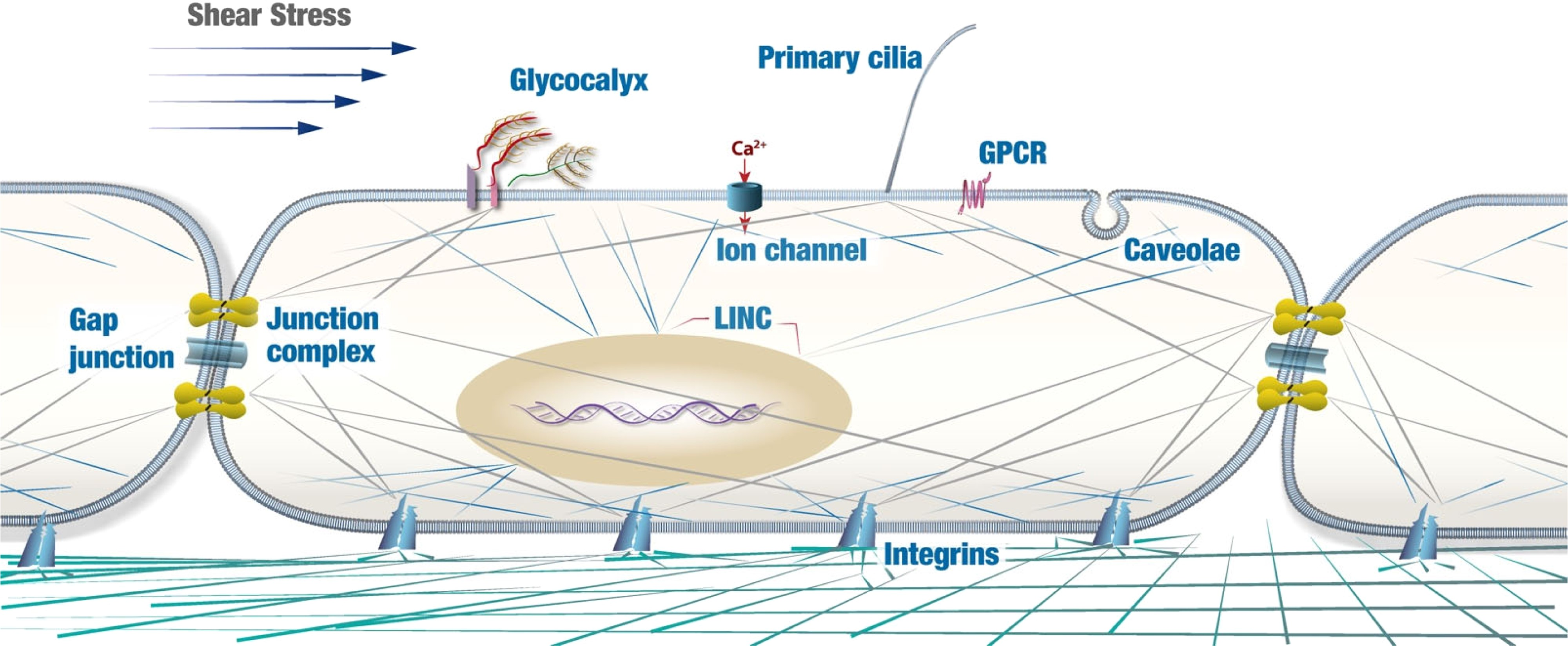
图5 内皮中的机械传感器感知生物力学信号并将其转化为生物信号。糖萼、初级纤毛、离子通道、细胞-细胞和细胞-底物粘附复合物、G 蛋白偶联传感器、小窝和 NE 蛋白(如 LINC 复合物)与流体力学的转导有关。
上述内皮机械传感器要么直接通过改变蛋白质活性或离子转运的构象变化,要么通过启动影响基因转录、细胞周期和其他与心血管病理生理学相关程序的信号转导通路的复杂网络来感知和响应机械应力(图6)。迄今为止的研究揭示了一个复杂的信号网络,不同的血流动力学力通过该网络影响 EC 功能和动脉粥样硬化形成。此外,细胞内不同的机械感应元件相互整合,形成分子回路,协调细胞对机械信号的反应。
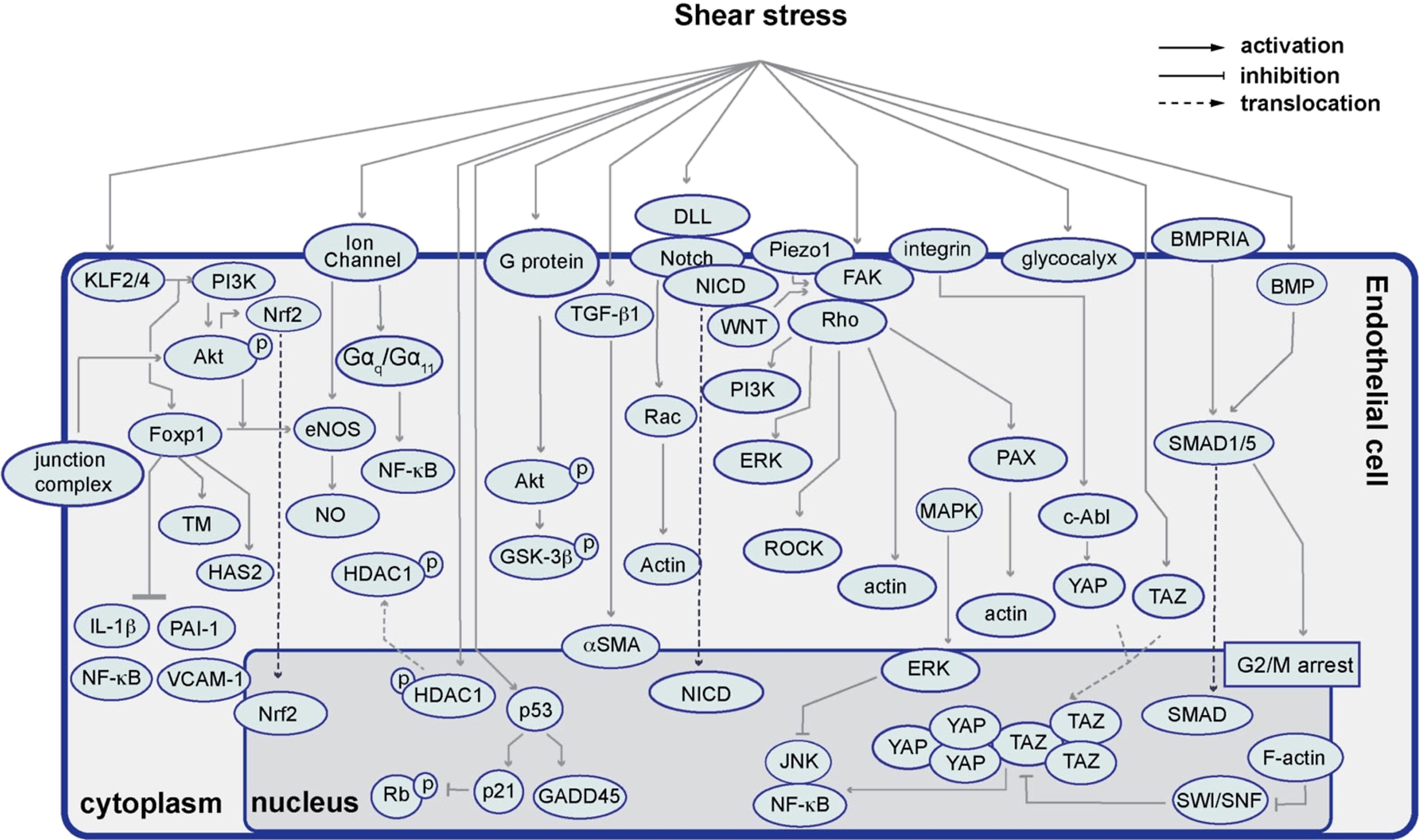
图6 参与 FSS 介导的内皮功能的 EC 机械转导通路。
动脉粥样硬化中机械转导通路的药理学靶向
如上所述,许多机械转导通路参与内皮细胞对血流和 SS 诱导的动脉粥样硬化的反应。下表概述了目前可以改变 ECs 机械转导的抗动脉粥样硬化药物(表1)。
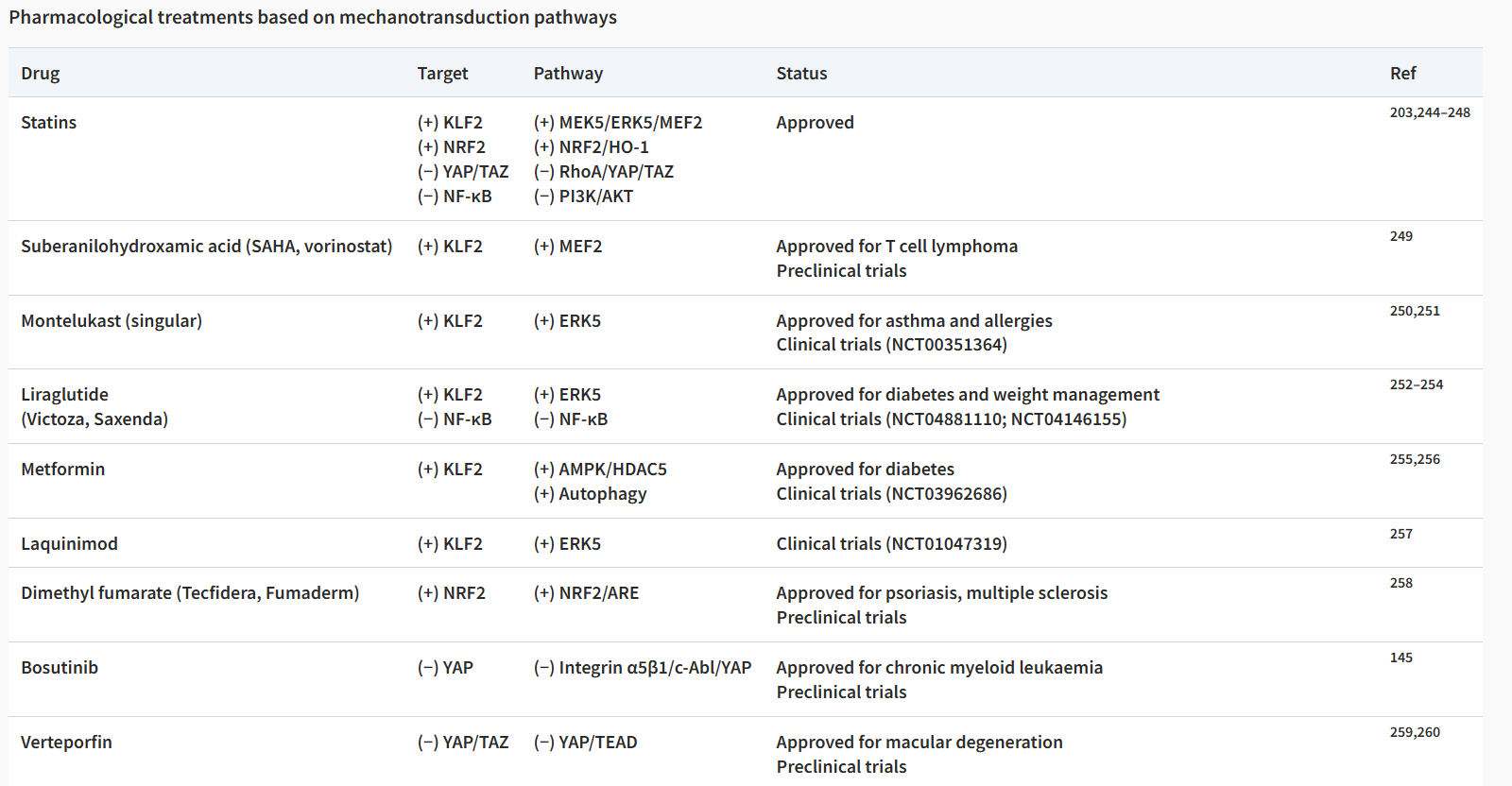
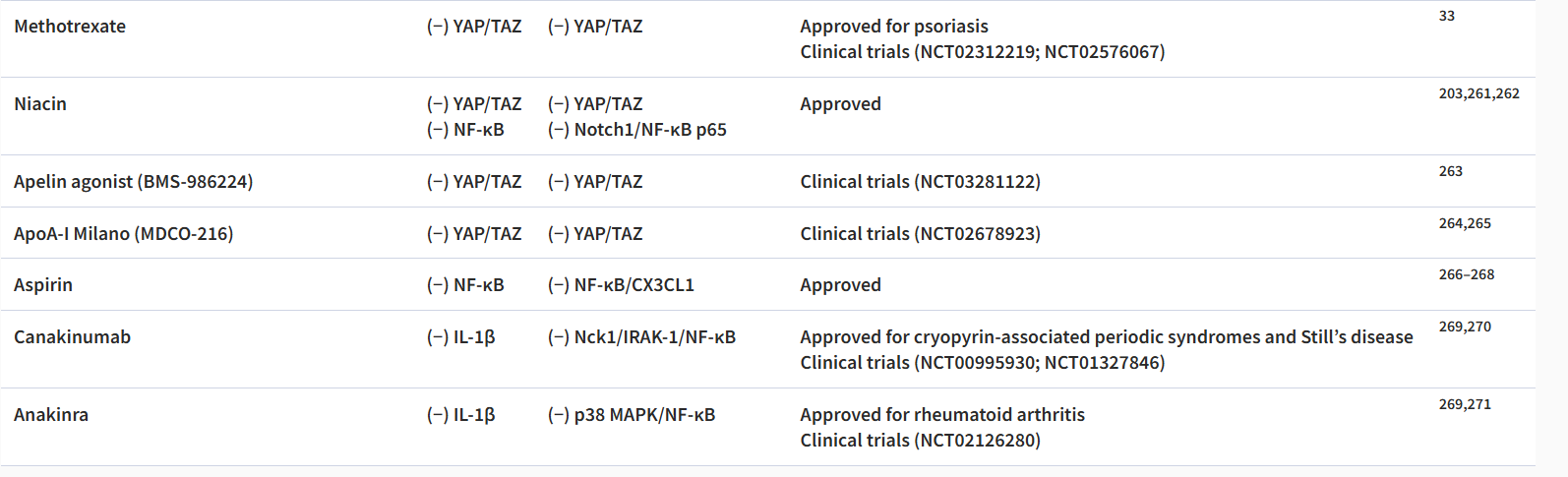
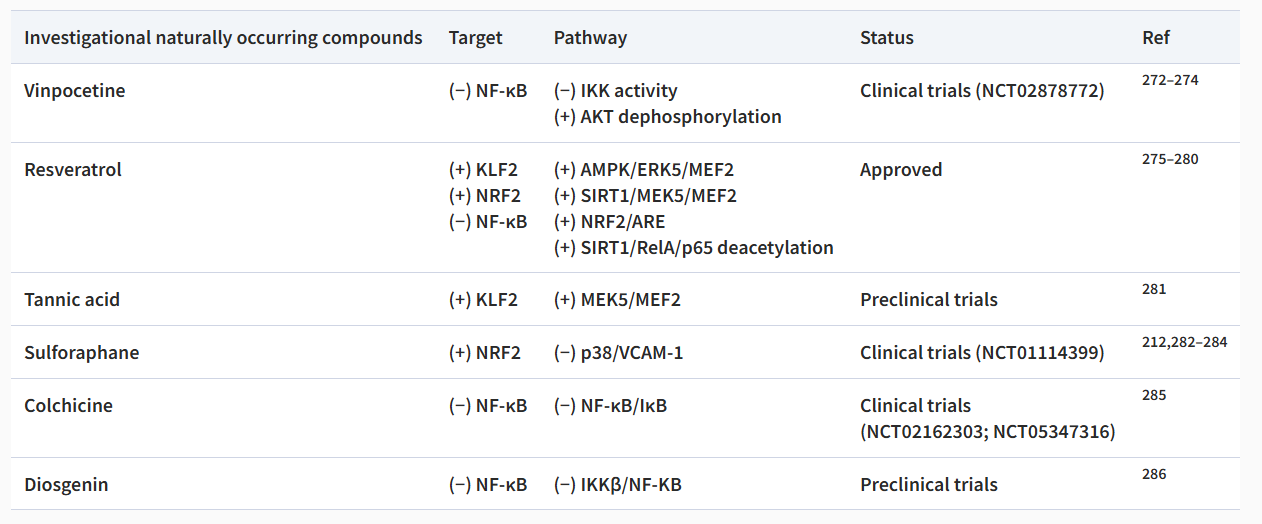 表1 基于机械转导途径的药物治疗。
表1 基于机械转导途径的药物治疗。
内皮力学生物学的复杂性在对抗 CVD 的斗争中既带来了机遇,也带来了挑战。一方面,正在发现新的机械敏感通路,并与动脉粥样硬化形成过程中的内皮功能障碍有关。这些通路可能揭示预防或逆转 CVD 的新靶点。另一方面,该系统的复杂性需要新的实验工具和概念上的进步,以推进我们对内皮机械生物学如何促进抗动脉粥样硬化环境中的稳态以及促进致动脉粥样硬化区域的疾病进展的理解。这对于开发毒性最小的稳健疗法至关重要。
参考文献:Wang X, Shen Y, Shang M, Liu X, Munn LL. Endothelial mechanobiology in atherosclerosis. Cardiovasc Res. 2023 Jul 6;119(8):1656-1675. doi: 10.1093/cvr/cvad076. PMID: 37163659; PMCID: PMC10325702.
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!






